DECOMPOSIÇÃO TÉRMICA DE 33R11- E 3,22- IONENOS.
Eloise Berwig (IC), Marly da S. Soldi (PQ), Alfredo T. N. Pires (PQ) e
Valdir Soldi(PQ)
.
Laboratório de Materiais Poliméricos (Polimat)-Departamento de Química, UFSC, 88040-900 - Florianópolis, SC (vsoldi@qmc.ufsc.br).
palavras-chave: ionenos, decomposição térmica, energia de ativação
Ionenos são polímeros que apresentam em sua estrutura grupos amônio quaternários cujas cargas positivas estão distribuídas ao longo da cadeia principal e em geral contrabalançadas por ânions como brometo ou cloreto. As principais aplicações estão associadas com a ação fungicida e bactericida, como anticoagulantes, floculantes para soluções coloidais, condutores elétricos na forma de complexos e catalisadores de reações de hidrólise.1-3 No presente trabalho foram determinados os parâmetros cinéticos e termogravimétricos para a decomposição térmica dos 33R11- e 3,22-Ionenos.
Os polímeros 33R11- e 3,22- foram provenientes de trabalhos anteriores do grupo. Os estudos de análise térmica foram realizados num sistema Shimadzu (DSC e TGA 50) em nitrogênio (fluxo de 50 cm3 min-1) e na presença de ar.
![]()
Os parâmetros cinéticos e termogravimétricos para a decomposição térmica dos sistemas estudados são apresentados na Tabela 1. As temperaturas máximas de decomposição para o 33R11 em nitrogênio e na presença de ar foram 277 e 281 °C, respectivamente. Para o 3,22 em nitrogênio foram observadas três estágios de decomposição com temperaturas máximas em 288, 366 e 486 °C. Na presença de ar foram observadas somente duas temperaturas em 292 e 485 °C. Este comportamento indica que não ocorrem mudanças significativas na decomposição destes polímeros devido a presença de ar. A porcentagem de massa residual em nitrogênio e na presença de ar, determinada a 600 °C, foi a mesma para o 33R11 porém, foi maior para o 3,22 quando a decomposição foi realizada na presença de ar. Os valores da energia de ativação (Ea) foram determinados pelos métodos de Ozawa4 e de Freeman-Carroll.5 Os valores de Ea determinados pelo método de Ozawa (sistemas em N2) são mostrados na Figura 1 em função da fração de decomposição (a). Para o 33R11 a Ea diminui com o aumento de a, indicativo de mudanças no mecanismo de decomposição. Um comportamento distinto foi observado para o 3,22 já que até a=0,45 os valores de Ea variam aleatoriamente na faixa de 90 a 120 kJ mol-1 aumentando a partir da fração considerada até um valor de 140 kJ mol-1 quando a=0,7. Este comportamento está aparentemente associado a diferenças na estrutura química dos dois polímeros estudados. Geralmente o mecanismo de decomposição está associado a cisão das cadeias poliméricas favorecendo portanto o 33R11 por apresentar ramificações ao longo da cadeia
Tabela 1. Parâmetros cinéticos e termogravimétricos para a decomposição térmica dos 33R11- e 3,22-Ionenos.


 OZAWA FREEMAN-CARROLL
OZAWA FREEMAN-CARROLL
Sistemas TMAXa Eab Log A Ea Log A rc Resíduod
(°C) (kJ/mol) (min-1) (kJ/mol) (min-1) (%)

33R11(N2) 277 125,4 11,8 128,1 10,0 0,9993 11,5 93,0 6,4 0,9984
33R11(ar) 281 ------ 95,8 3,9 0,9997 11,9
63,8 --- 0,9994
3,22(N2) 288 114,8 9,9 169,0 10,4 0,9996 3,2
71,0 --- 0,9994
366 118,7 9,2 89,4 1,7 0,9997
486 ------ 135,7 3,9 0,9998
3,22(ar) 292 ------ 87,6 2,4 0,9993 8,8
485 ------ 116,8 2,5 0,9996
 a
Valores determinados considerando-se a derivada (DrTGA). b
Valores determinados considerando-se a média dos valores
conforme Figura 1. c Representa o coeficiente de
correlação para os valores determinados pelo método
de Freeman-Carroll. d Valores determinados a 600 °C
na taxa de aquecimento de 10 °C/min.
a
Valores determinados considerando-se a derivada (DrTGA). b
Valores determinados considerando-se a média dos valores
conforme Figura 1. c Representa o coeficiente de
correlação para os valores determinados pelo método
de Freeman-Carroll. d Valores determinados a 600 °C
na taxa de aquecimento de 10 °C/min.
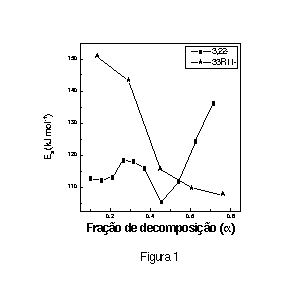
principal.
A análise do valores de Ea mostra que a medida que
a aumenta a decomposição
térmica do 33R11 é favorecida (a Ea
diminui), enquanto que o 3,22, aparentemente um sistema mais
estável, o processo de decomposição é
dificultado (a Ea aumenta). Os valores de Ea
determinados através do método de Freeman-Carroll
(Tabela 1) confirmam a presença de mais de um mecanismo de
decomposição para os sistemas estudados tanto em
nitrogênio como na presença de ar. Resultados
preliminares através da técnica de Ftir indicam que o
mecanismo de
decomposição ocorre via cisão randômica das cadeias com formação
de produtos gasosos e estruturas insaturadas.
Os resultados mostraram que a decomposição dos sistemas estudados ocorre através de mais um mecanismo de decomposição. Aparentemente o mesmo comportamento é observado em ambiente inerte e na presença de ar.
Kimura, E.T. et al., Proc. Soc. Exp. Biol. Med., 111, 37 (1962).
Moore, M. B., Medicinal Chemistry. Ed. By Alfred Burguer, 2a ed., New York (1966).
Noren, G. K. J. Polym. Sci., Polym. Chem. Ed. 13, 693 (1975).
Ozawa, T., J. Therm. Anal., 7, 601 (1975).
Chan, J. H. e Balke, S. T., Polym. Degrad. Stab. 57, 135 (1997).
[CNPq e UFSC]