ADIÇÃO DE NUCLEÓFILOS DE CARBONO À ÍONS IMÍNIO E N-ACILIMÍNIO CÍCLICOS PROMOVIDA POR InCl3.
Rogério Petersen (PG), Marla Godoi (IC) e Dennis Russowsky (PQ)
palavras- chave: b-aminocarbonílicos, Bases de Mannich, Íons Imínio.
Os compostos b-aminocarbonílicos são unidades largamente distribuídas na natureza e apresentam grande versatilidade do ponto de vista de suas atividades biológicas, bem como são de grande importância na preparação de outras classes de compostos orgânicos.
Estes sistemas podem ser construídos à partir de uma importante ferramenta: a reação de Mannich Bimolecular1. O uso de sais de imínio pré-formados2 ou a geração “in situ” de íons N-acilimínio3 nas reações com nucleófilos de carbono como silil enoléteres e silil ceteno acetais, tem expandido a versatilidade desta metodologia principalmente no que se refere ao emprego de condições suaves e a possibilidade da introdução de elementos de regio- e estereosseletividade.
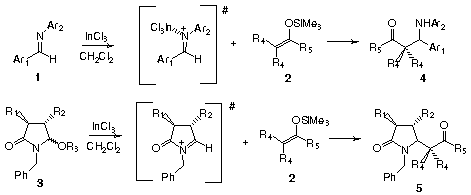
Neste trabalho são apresentados resultados preliminares do uso de tricloreto de índio4 (InCl3) em fase orgânica, como ativante de aldiminas aromáticas 1 nas reações com silil enoléteres e silil ceteno acetais 2, promovendo a formação de b-aminocetonas 4. Aborda também a habilidade do ácido de Lewis em promover a geração “in situ” de íons N-acilimínios cíclicos a partir das respectivas acetoxilactamas 3, que foram trapeados com os nucleófilos de carbono sililados 2 produzindo os respectivos adutos b-aminocarbonílicos 5 (Esquema 1).

As b-aminocetonas 4 foram obtidas com rendimentos que variaram entre 70% e 90%, empregando-se quantidades catalíticas de tricloreto de índio (10% em mol), enquanto que os rendimentos para os sistemas b-aminocarbonílicos 5 variaram entre 50% e 80% utilizando-se 80% em mol de InCl3, como mostrado na Tabela 1.
Tabela 1
|
Substratos |
Nucleófilos |
Adutos |
Rend. |
|||||||
|
|
Ar1 |
Ar2 |
R1 |
R2 |
R3 |
|
R4 |
R5 |
||
|
1a |
Ph |
Ph |
- |
- |
- |
2a |
H |
Ph |
4a |
70 |
|
1a |
Ph |
Ph |
- |
- |
- |
2b |
Me |
OMe |
4b |
85 |
|
1b |
Ph |
C6H4Br |
- |
- |
- |
2a |
H |
Ph |
4c |
82 |
|
1b |
Ph |
C6H4Br |
- |
- |
- |
2b |
Me |
OMe |
4d |
75 |
|
1c |
C6H4Br |
Ph |
- |
- |
- |
2a |
H |
Ph |
4e |
75 |
|
1c |
C6H4Br |
Ph |
- |
- |
- |
2b |
Me |
OMe |
4f |
70 |
|
1d |
Ph |
C6H4OC6H13 |
- |
- |
- |
2b |
Me |
OMe |
4g |
90 |
|
1e |
Ph |
C6H4OC10H21 |
- |
- |
- |
2b |
Me |
OMe |
4h |
85 |
|
3a |
- |
- |
H |
H |
Et |
2a |
H |
Ph |
5a |
15 |
|
3b |
- |
- |
H |
OAc |
Ac |
2a |
H |
Ph |
5b |
60 |
|
3b |
- |
- |
H |
OAc |
Ac |
2b |
Me |
OMe |
5c |
80 |
|
3c |
- |
- |
OAc |
OAc |
Ac |
2a |
H |
Ph |
5d |
50 |
|
3c |
- |
- |
OAc |
OAc |
Ac |
2b |
Me |
OMe |
5e |
85 |
Cabe ressaltar que a utilização de quantidades catalíticas de InCl3 na geração dos íons N-acilimínio cíclicos levaram à baixos rendimentos bem como o uso do precursor etoxilado 3a.
Os adutos b-aminocarbonílicos 5b, 5c e 5e foram obtidos como um único diastereoisômero, enquanto que o aduto 5d foi obtido como uma mistura de isômeros em uma proporção de 3:1.
As proporções dos diastereoisômeros foram determinadas através de CG e CG-MS e as estereoquímicas relativas dos produtos majoritários foram inferidas com base nos valores das constantes de acoplamento determinadas por 1H-RMN e por comparação com dados anteriormente descritos.
Os resultados indicam a viabilidade do uso de InCl3 como ativante de aldiminas aromáticas bem como na geração “in situ” de íons imínio e N-acilimínio a partir de acetoxilactamas. A sua utilização em reações de Mannich Bimoleculares e o estudo detalhado da diastereosseletividade observada em favor do aduto Trans poderão ser exploradas na síntese estereocontrolada de produtos naturais de interesse biológico.
Referências Bibliográficas:
[1] - Arend, M.; Westermann, B. and Risch, N., Angew. Chem. Int. Ed. Engl., 1998, 37, 1045. b)Pilli, R. A. and Russowsky, D., Trends in Organic Chemistry, 1997, 6,101.
[2] - Pilli, R. A. and Russowsky, D., 1987, J. Chem. Soc. Chem. Commun.,1053.
[3] - Pilli, R. A. and Russowsky, D., 1996, J. Org. Chem., 61, 3187.
[4] - Loh, T-P. and Wei, L-L., Tetrahedron Lett., 1998, 39, 323.
FAPERGS, CNPq, PADCT