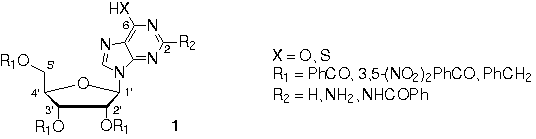NUCLEOSÍDEOS
QUINOLÔNICOS E PIRAZOLOQUINOLÍNICOS COMO INIBIDORES DA
ENZIMA GLICERALDEÍDO-3-FOSFATO DESIDROGENASE (gGAPDH) DE
TRYPANOSOMA CRUZI
Marcus
Mandolesi Sá (PQ),a Ricardo Luís
Araújo Dias (PG),b Jaime Rodrigues Bascuñan
(PQ),c Glaucius Oliva (PQ),d Mara
Rita P. de Oliveira (PG),e Anderson D. da
Matta (PG),f Bianca d’Arantes Lucero
(IC),f Carla M. de O. Lepsch (PG),f
Carla Verônica B. dos Santos (PG),f Claudia
Regina B. Gomes (PG),f Maria Cecília B. V.
de Souza (PQ), f Thatyana R. Alves (PG),f
Vitor F. Ferreira (PQ).f
aDepartamento
de Química, Universidade Federal de Santa Catarina (DQ-UFSC);
bDepartamento de Química, Universidade Federal de
São Carlos (DQ-UFSCar);
cCentro
de Ciências Tecnológicas, Universidade do Sul
(CCT-UNISUL);
dInstituto
de Física de São Carlos, Universidade de São
Paulo (IFSC-USP);
eInstituto
de Química, Universidade Federal do Rio de Janeiro (IQ-UFRJ);
fInstituto
de Química, Universidade Federal Fluminense (IQ-UFF).
palavras-chave:
doença de Chagas; inibidores de gGAPDH; nucleosídeos
A
doença de Chagas é causada pelo protozoário
Trypanosoma cruzi e representa um grave problema de saúde
pública em países tropicais como o Brasil. A técnica
de planejamento racional de fármacos tem sido aplicada no
desenho de inibidores de gliceraldeído-3-fosfato desidrogenase
glicossomal (gGAPDH) de T. cruzi, uma enzima essencial ao
parasita.1 Através da determinação da
estrutura de gGAPDH por difração de raio-X, modelagem
molecular e “docking” da região do sítio do
co-fator NAD+, um conjunto de moléculas que
representam candidatos a inibidores seletivos de gGAPDH foi
selecionado para síntese, destacando-se alguns derivados de
nucleosídeos purínicos. Dentre os vários
análogos sintetizados, somente aqueles contendo grupos
aromáticos nas posições 2’-, 3’- e 5’-
do anel da ribose apresentaram atividade inibitória elevada
(1, IC50 = 70-250mM).2
Apesar
de pouco explorada neste estudo, a importância da base
nitrogenada como um grupo farmacofórico nos nucleosídeos
pôde ser evidenciada. Dessa forma, o presente trabalho objetiva
estudar a atividade inibitória frente à gGAPDH de
nucleosídeos contendo bases nitrogenadas modificadas, como os
derivados tribenzoilados quinolônicos e pirazoloquinolínicos
2-13. É interessante destacar que alguns destes
análogos nucleosídicos apresentam atividade inibitória
frente à transcriptase reversa do HIV-1 e ao vírus
herpes simplex do tipo 1.3
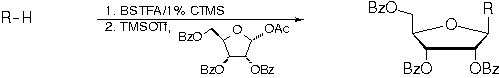
A
metodologia empregada para a síntese dos nucleosídeos
2-13 utiliza a reação de acoplamento entre uma
base nitrogenada adequada, previamente sililada, e
1-O-acetil-2,3,5-tri-O-benzoil-b-D-ribofuranose.3,4
Testes
de inibição de gGAPDH dos derivados de nucleosídeos
2-13
COMPOSTO
|
R
|
R1
|
R2
|
R3
|
IC50
(mM)
|
|
2
|

|
CH3
|
H
|
|
70
|
3
|
NO2
|
H
|
|
70
|
|
4
|
CI
|
H
|
|
40
|
|
5
|
Br
|
H
|
|
75
|
|
6
|
H
|
CI
|
|
N.D.
|
|
7
|
H
|
Br
|
|
120
|
|
8
|

|
H
|
Br
|
Br
|
55
|
|
9
|
H
|
Br
|
CI
|
45
|
|
10
|
Br
|
H
|
CI
|
50
|
|
11
|
CH3
|
H
|
OCH3
|
45
|
|
12
|
CH3
|
H
|
Br
|
INSOL.
|
|
13
|
CH3
|
H
|
F
|
> 200
|
Pelos resultados
apresentados na Tabela, observa-se que grande parte dos nucleosídeos
testados apresenta atividade inibitória acentuada (IC50
= 40-80mM). Excetuando-se o
composto 7, os derivados contendo cloro e bromo em R1
e R2 estão entre os mais ativos (estruturas 4,
5, 8-10; IC50 = 40-75mM).
Dentre as bases nitrogenadas estudadas, os derivados
pirazoloquinolínicos 8-11 são os inibidores mais
potentes (IC50 = 45-55mM).
Em conclusão,
nucleosídeos quinolônicos e pirazoloquinolínicos
tri-O-benzoilados são inibidores potentes de gGAPDH de T.
cruzi. Outros análogos de nucleosídeos estão
sendo sintetizados e submetidos aos testes de inibição
enzimática, buscando obter um modelo mais adequado ao
entendimento do mecanismo de reconhecimento molecular entre a enzima
e o inibidor.
1) Souza, D. H.
F.; Garrat, R. C.; Araújo, A. P. U.; Guimarães, B. G.;
Jesus, W. D. P.; Michels, P. A. M.; Hannaert, V.; Oliva, G. FEBS
Letters 1998, 424, 131.
2)
Sá, M. M.; Dias, R. L. A.; Vieira, P. C.; Oliva, G. 22a
Reunião Anual da Sociedade Brasileira de Química (SBQ)
1999, Poços de Caldas (MG), MD-040.
3)
(a) da Matta, A. D.; dos Santos, C. V. B.; Pereira, H. S.;
Frugulhetti, I. C. P. P.; de Oliveira, M. R. P.; de Souza, M. C. B.
V.; Moussatché, N.; Ferreira, V. F. Heteroatom Chemistry
1999, 10, 197. (b) Pinto, A. C.; Pereira, H. S.;
Frugulhetti, I. C. P. P.; de Oliveira, M. R. P.; de Souza, M. C. B.
V.; Moussatché, N.; Ferreira, R. L.; Alves, T. R. 8th
Brazilian Meeting on Organic Synthesis (BMOS) 1998, São
Pedro (SP), OS-089.
4)
da Matta, A. D.; Bernardino, A. M. R. B.; Romeiro, G. A.; de
Oliveira, M. R. P.; de Souza, M. C. B. V.; Ferreira, V. F.
Nucleosides & Nucleotides 1996, 15, 889.
FAPESP/CNPq-PIBIC/PADCT-SBIO/FINEP/WHO/Howard
Hughes/CAPES/FAPERJ