SÍNTESE
TOTAL DE ALCALÓIDES DE AMARYLLIDACEAE VIA ACOPLAMENTO
ARILA-ARILA PALÁDIO-CATALISADO
José C.
Torres(PG), Simon J. Garden(PQ) e Angelo C. Pinto(PQ)
Departamento de Química
Orgânica - Instituto de Química – UFRJ
palavras-chave: isatina; pirrolofenantridina;
acetato de paládio II
 Os
alcalóides do tipo 1H-pirrolo[3,2,1-de]fenantridinas,
isolados de várias espécies da família
Amaryllidaceae são compostos oxigenados que possuem
importantes atividades biológicas.1 Dentre estes
alcalóides destaca-se, a hipadina 2b, que
mostrou-se um inibidor reversível da fertilidade de ratos
machos.2 Outros exemplos incluem a kalbretorina 2c
que exibi atividade antitumoral3 e um composto análogo,
ungeremina 3, que mostrou-se um potente
antileucêmico(Figura).4
Os
alcalóides do tipo 1H-pirrolo[3,2,1-de]fenantridinas,
isolados de várias espécies da família
Amaryllidaceae são compostos oxigenados que possuem
importantes atividades biológicas.1 Dentre estes
alcalóides destaca-se, a hipadina 2b, que
mostrou-se um inibidor reversível da fertilidade de ratos
machos.2 Outros exemplos incluem a kalbretorina 2c
que exibi atividade antitumoral3 e um composto análogo,
ungeremina 3, que mostrou-se um potente
antileucêmico(Figura).4
1a
R=CH3 Oxoassoanina 2a R=CH3;
R'=H Pratosina 3 Ungeremina
1b
R=-CH2- Anidrolicorin-7-ona 2b R=-CH2-;
R'=H Hippadina
2c
R=-CH2-, R'=OH Kalbretorina
Figura
Embora
algumas rotas sintéticas empreguem estratégias mais
elaboradas para obtenção destes alcalóides, a
maioria das rotas sintética envolvem a formação
de ligações arila-arila inter ou intramolecular
através de reações de acoplamento.1
Em nossas investigações sobre a química de
isatinas, desenvolvemos uma metodologia eficiente para a obtenção
dos derivados pirrolofenantridina via reações de
acoplamento intramolecular arila-arila
paládio-catalisado.5-6
Este
trabalho tem por objetivo, a síntese total dos alcalóides
de Amaryllidaceae oxoassoanina 1a e
pratosina 2a, empregando o acoplamento arila-arila
paládio-catalisado para a obtenção do esqueleto
pirrolofenantridina(Esquema).
A
N-benzilação da isatina 4 através
da reação com cloreto de 2-iodo-4,5-dimetoxibenzila 5,
na presença de carbonato de potássio e iodeto de
potássio em DMF,7 forneceu a respectiva
N-benzilisatina 6 em 90-92% de rendimento. A
proteção da carbonila cetônica de 6,
através da reação com etilenoglicol na presença
de quantidade catalítica de ácido p-toluenossulfônica,
levou ao cetal 7 em altos rendimentos. Este, através
do aquecimento na presença de 10% molar de acetato de paládio
II, 1 equivalente de Bu4NBr e 5 equivalentes de KOAc, em
DMF; foi convertido no produto de ciclização 8
em 81-87% de rendimento.
A
desproteção da carbonila cetônica de 8
forneceu a 9,10-dimetoxipirrolo[3,2,1-de]fenantridin-4,5-diona
9 em 86-91% de rendimento. O posterior tratamento de 9
com excesso do complexo borana-tetrahidrofurano à temperatura
ambiente,8 seguido da reação com
cianoborohidreto de sódio em ácido acético,9
levou ao alcalóide instável, a assoanina 10.
Esta, através da oxidação com permanganato de
potássio, foi convertida no alcalóide estável, a
oxoassoanina 1a, em 68-72% de rendimento a partir de
9.
Por
outro lado, a agitação da pirrolofenantridin-4,5-diona
9 com complexo borana-tetrahidrofurano à
temperatura ambiente, seguida do aquecimento sob refluxo em benzeno,
na presença de dióxido de manganês(MnO2-sílica),
forneceu a pratosina 2a em 36% de rendimento a partir
de 9.
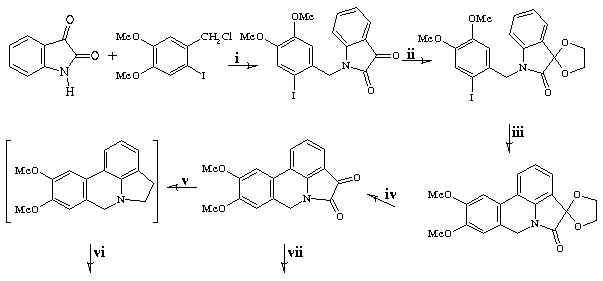
4
5
6(90-92%)
7(93-94%)
10
Assoanina 9(86-91%)
8(81-87%)
1a
Oxoassoanina (68-72%) 2a Pratosina (36%)
i.1)
4/K2CO3/DMF/40-600C/0,5h;
2)Adição 5/KI/40-600C/3h;
ii.etilenoglicol/tolueno/TsOH/
refluxo/5h;
iii.10%molar Pd(OAc)2/Bu4NBr/KOAc/DMF/1000C/9-10h;
iv.HCl 6N/THF/refluxo/
5h;
v.1)BH3/THF/t.a./3h; 2)NaBH3CN/HOAc/t.a./3h;
vi)KMnO4/NaOH 3N/CH2Cl2/t.a./2h;
vii.1)BH3/THF/t.a./2,5h;
2)MnO2-silica/benzeno/refluxo/4h
Esquema
Esta estratégia
sintética permitiu a síntese total dos alcalóides
de Amaryllidaceae oxoassoanina 1a e pratosina
2a a partir da isatina, em 40-49% e 21-25% de
rendimento global, respectivamente. Além disso, o alcalóide
instável assoanina 10, foi um dos
intermediários obtidos durante a síntese da
oxoassoanina.
(1)Hoshino,
O. 1998 The Amaryllidaceae Alkaloids, in: The
Alkaloids - Chemistry and Biology. Vol. 51, (Editor Cordell,
G.A.), Academic Press, London, 323. (2)Chattopadhyay,
S.C. et al., 1983 Planta Med., 49, 252.
(3) Ghosal, S. et al., 1985 Phytochemistry,
24, 1825. (4) Zee-Cheng, R.K.-Y. et al., 1978
J. Med. Chem., 21, 199. (5)Torres, J.C. et
al. 1998 Livro de Resumos da 21a
Anual da SBQ, Vol. 2; QO-113. (6)Torres, J.C. et al.,
1998 Abstracts - 8th Brazilian Meeting on
Organic Synthesis, PS-160. (7)Torres, J.C. et al.,
1998 Livro de Resumos da 21a Reunião
Anual da SBQ, Vol. 2; QO-076. (8)Torres, J.C. et al.,
1999 Tetrahedron, 55, 1881-1892. (9)Gribble,
G.W. and Hoffman, J.H., 1977 Synthesis, 859.
[CNPq]
 Os
alcalóides do tipo 1H-pirrolo[3,2,1-de]fenantridinas,
isolados de várias espécies da família
Amaryllidaceae são compostos oxigenados que possuem
importantes atividades biológicas.1 Dentre estes
alcalóides destaca-se, a hipadina 2b, que
mostrou-se um inibidor reversível da fertilidade de ratos
machos.2 Outros exemplos incluem a kalbretorina 2c
que exibi atividade antitumoral3 e um composto análogo,
ungeremina 3, que mostrou-se um potente
antileucêmico(Figura).4
Os
alcalóides do tipo 1H-pirrolo[3,2,1-de]fenantridinas,
isolados de várias espécies da família
Amaryllidaceae são compostos oxigenados que possuem
importantes atividades biológicas.1 Dentre estes
alcalóides destaca-se, a hipadina 2b, que
mostrou-se um inibidor reversível da fertilidade de ratos
machos.2 Outros exemplos incluem a kalbretorina 2c
que exibi atividade antitumoral3 e um composto análogo,
ungeremina 3, que mostrou-se um potente
antileucêmico(Figura).4