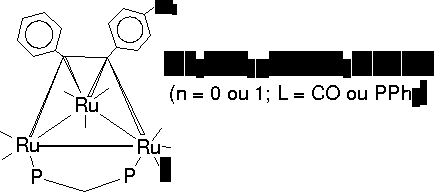COMPORTAMENTO
ELETROQUÍMICO DO COMPLEXO INSATURADO
[Ru3(CO)7(dppm)(4-O2N-PhC2Ph)]
(1) E
SEUS DERIVADOS SATURADOS [Ru3(CO)7L(dppm)(4-O2N-PhC2Ph)]
(L
= CO (2), PPh3 (3))
Renato
Rosseto (PG), Edison Stein (PQ) e Maria D. Vargas (PQ)
Laboratório
de Organometálicos - Instituto de Química - UNICAMP
CP 6154 - CEP:
13081-970 - Campinas - SP - Brasil.
palavras-chave:
clusters de rutênio, voltametria cíclica, óptica
não linear.
Grande
parte dos trabalhos sobre óptica não linear (ONL) com
ênfase na geração do segundo harmônico
envolve sistemas contendo fragmentos doadores e receptores ligados
por uma ponte conjugada,1
sendo raros os exemplos em que são utilizadas espécies
apresentando ligação metal-metal.2
Estudos de voltametria cíclica permitem a investigação
da comunicação eletrônica existente entre os
fragmentos doador e receptor, podendo ser analisada a influência
de cada fragmento sobre o outro.
O
presente trabalho versa sobre a eletroquímica dos clusters
trinucleados de rutênio, esquematizados abaixo, cuja síntese
foi descrita anteriormente3.
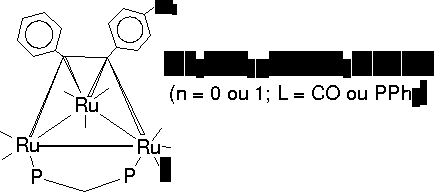
Esses
complexos apresentam-se como bons candidatos para ONL, uma vez que,
quando comparados com as espécies mononucleadas, são
mais polarizáveis e possuem grande capacidade de estabilizarem
cargas, além de permitirem a coordenação de
ligantes diferentes em cada átomo metálico, promovendo
assimetria.
O
voltamograma cíclico do complexo [Ru3(CO)7(dppm)(PhC2PhNO2)]
1 em CH2Cl2, eletrodo de platina, a 200
mV/s e à temperatura ambiente, utilizando Bu4NClO4
como eletrólito suporte, mostra dois picos catódicos
que exibem processos de reoxidação diretamente
associados. O primeiro pico, E1/2 = -0,84 V, DE
= 90 mV, corresponde à redução do ligante
orgânico 4-nitrodifenilacetileno no complexo, através do
processo de transferência de dois elétrons e o segundo
pico, E1/2 = -1,39 V, DE
= 103 mV, correspondente a um processo quasi-reversível de
transferência de um elétron, atribuído à
redução do fragmento metálico. A quantidade de
elétrons transferidos no processo de redução foi
avaliada através do voltamograma cíclico e da
voltametria de pulso normal de uma solução equimolar do
ligante livre e ferroceno.
Quando
é borbulhado CO ou adicionada PPh3 a uma solução
de 1 em CH2Cl2, há uma imediata
mudança da cor verde para vermelho e o monitoramento através
da espectroscopia no IV na região de nco
mostra que os complexos [Ru3(CO)8(dppm)(PhC2PhNO2)]
2 ou [Ru3(CO)7PPh3(dppm)(PhC2PhNO2)]
3, respectivamente, são formados quantitativamente.4
O voltamograma cíclico do complexo 2 apresenta um pico
catódico quasi-reversível em E1/2 = -1,13 V,
DE
= 145 mV, que corresponde à redução do ligante
orgânico nitro no complexo, um par de picos quasi-reversíveis
em E1/2 = -1,41 V, DE
= 103 mV, atribuído à redução do
fragmento metálico e um pico de reoxidação de
fragmentos eletrogerados em Ep = -0,78 V. O complexo 3
apresenta praticamente o mesmo comportamento eletroquímico.
Podem ser observados um par de picos quasi-reversíveis em
E1/2 = -1,19 V, DE
= 150 mV, atribuído à redução do ligante
orgânico nitro no cluster, um pico irreversível em Ep =
-1,77 V correspondendo à redução do complexo
metálico e um pico de reoxidação em Ep = -0,77 V
que corresponde à reoxidação de fragmentos
eletrogerados. O número de elétrons transferidos na
redução do centro metálico que era originalmente
de um elétron no complexo insaturado 1 passa a dois
elétrons nos complexos saturados 2 e 3, como
observado nos experimentos de voltametria de pulso normal.
O
comportamento eletroquímico do complexo insaturado 1 e
dos compostos saturados 2 e 3 leva às seguintes
considerações:
a
complexação do ligante orgânico nitro na base
metálica faz com que o seu potencial de redução
seja diminuído de E1/2 = -1,00 V (ligante livre),
para E1/2 = -0,84 V (ligante coordenado),
comprovando a complexação da espécie.
a
resposta eletroquímica da adição de CO ao
complexo insaturado 1, originando 2, mostra que há
um pequeno deslocamento no potencial de redução para
potenciais catódicos de –1,39 para -1,41 V do centro
metálico e de –0,84 para -1,13 V no ligante orgânico.
quando
é adicionada PPh3 ao complexo 1, resultando
no complexo saturado 3, o potencial de redução
do centro metálico passa de –1,39 para um potencial mais
catódico de –1,77 V e o potencial do ligante orgânico
vai de –0,84 para –1,19 V.
a
adição das bases de Lewis CO e PPh3 ao
complexo insaturado 1 leva aos complexos 2 e 3,
respectivamente, que apresentam processos de redução
mais irreversíveis que os do composto original e a potenciais
mais negativos.
os
potenciais de redução no complexo 3 são
mais negativos do que no complexo 2, o que está de
acordo com a ordem de basicidade dos ligantes, CO <
PPh3.
quando
são adicionados os ligantes CO ou PPh3 ao complexo
insaturado 1, o potencial de redução do ligante
orgânico passa de –0,84 V para –1,13 V em 2 e
–1.19 V em 3, demonstrando que o ligante PhC2PhNO2
complexado é muito sensível à basicidade dos
grupos CO e PPh3, devido à capacidade do grupo
substituinte NO2 retirar elétrons.
1
J.Heck, S.Dabek, T.M-Friedrichsen, H.Wong, Coord.Chem.Rev.,
1999, 190, 1217.
2
W-Y.Wong, W-T.Wong, J.Chem.Soc.,Dalton Trans.,1996,
3209.
3
R.Rosseto, M.D.Vargas, 22a Reunião Anual da
SBQ, QI-58.
4
S.Rivomanana, G.Lavine, N.Lugan, J-J.Bonnet, Organometallics,
1991, 10, 2285.
[CAPES]