SÍNTESE FORMAL DO ADOÇANTE NATURAL (-)-MONATINA
Davi de Jesus Oliveira (PG) ) e Fernando Coelho (PQ
Depto de Química Orgânica – IQ – UNICAMP – 13083-970 – Campinas, SP
palavras-chave: monatina, ácido L-glutâmico, indol
1. Introdução: A busca por substâncias que apresentem um alto teor dulcífero e que possam ser utilizadas ou como adoçantes sintéticos, ou que sirvam de protótipo para o desenvolvimento de novos adoçantes continua a despertar um grande interesse. Dentre as substâncias de origem natural dotadas de alto potencial dulcífico descobertas recentemente, podemos destacar a (-)-MONATINA, que apresenta uma doçura relativa de 1200 a 1400 vezes maior do que a sucrose. Essa substância, um aminoácido natural presente nas raízes da planta africana Schlerochiton ilicifolius, foi isolada em 1992 por Vleggaar e cols1.
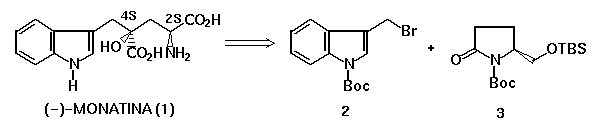
2. Objetivo: Dando continuação a um estudo iniciado em nosso laboratório, o nosso trabalho visa estabelecer uma estratégia sintética para a obtenção da (-)-MONATINA (1) (esquema 1).

Como apresentado na análise retrossintética, no nosso entender a obtenção da (-)-MONATINA passa por duas etapas críticas: oxidação e alquilação diastereosseletivas de enolatos da lactama 3, visando gerar o centro quaternário 4S. A estereoquímica desse centro pode em principio, ser controlada pelo substituinte volumoso presente no carbono 2S.
3. Resultados e Discussão: O brometo 2 foi preparado em 5 etapas com rendimento global de 59% a partir do indol. A lactama 3 foi preparada em 4 etapas com rendimento global de 65% a partir do ácido L-glutâmico. As metodologias utilizadas na preparação dos dois intermediários já foram alvo de trabalho apresentado anteriormente2a.
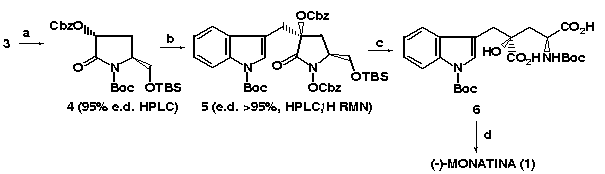
3.2. Alquilação de 4: As condições de alquilação diastereosseletiva do enolato da lactama 2 já haviam sido otimizadas anteriormente.2b Baseado neste resultado executamos a alquilação do enolato da lactama 4 com brometo 2. A análise por HPLC quiral e 1H RMMN detectou a presença de 5, como um único diastereoisômero. A obtenção do centro quaternário, através dessa etapa de alquilacão foi efetuada com um rendimento químico de 75% (esquema 2). O produto alquilado foi caracterizado pela análise combinada dos espectros 1D e 2D de RMN 1H e a configuração 4S confirmada por análise de NOESY 1D.
3.3. Hidrólise Básica e Oxidação de 5: A abertura do anel lactâmico e a clivagem do grupo CBz foram realizadas em uma só etapa, pelo tratamento do intermediário 5 com uma mistura de LiOH (1M) e H2O-THF. O produto hidrolisado foi oxidado com reagente de Jones para fornecer o diácido 6, o qual foi caracterizado por RMN 1H. O rendimento global a partir do intermediário 5 foi de 65%. A clivagem dos grupamentos de proteção dos nitrogênios com TFA resultará na (-)-MONATINA (esquema 2).
4. Conclusões: A alquilação do enolato da lactama 4 permitiu a formação do centro quaternário em C4 (os dados de RMN 1H sugerem configuração S) com rendimento de 75% e excelente diastereosseletividade. Essa estratégia sintética nos permitiu desenvolver uma nova metodologia de geração de um centro quaternário oxidado, sem precedentes na literatura. O sucesso na etapa de desproteção nos permitirá descrever a primeira síntese assimétrica da Monatina. A metodologia desenvolvida deve permitir preparar outros derivados assimétricos, visando um futuro estudo da relação estrutura-atividade adoçante.
5. Bibliografia: 1. Vleggaar, R., Ackerman, L.G.J. and Steyn, P.S., J.C.S. Perkin Trans. I, 1992, 3095; 2.a. Oliveira, D. J. and Coelho, F. A. S. 8th BRAZILIAN MEETING ON ORGANIC SYNTHESIS, P-075, 7-11 September, 1998, São Pedro-SP; b. Oliveira, D. J. and Coelho, F. A. S. Synth. Comm., 2000, 30(12), 0000.
[CNPQ, FAPESP]