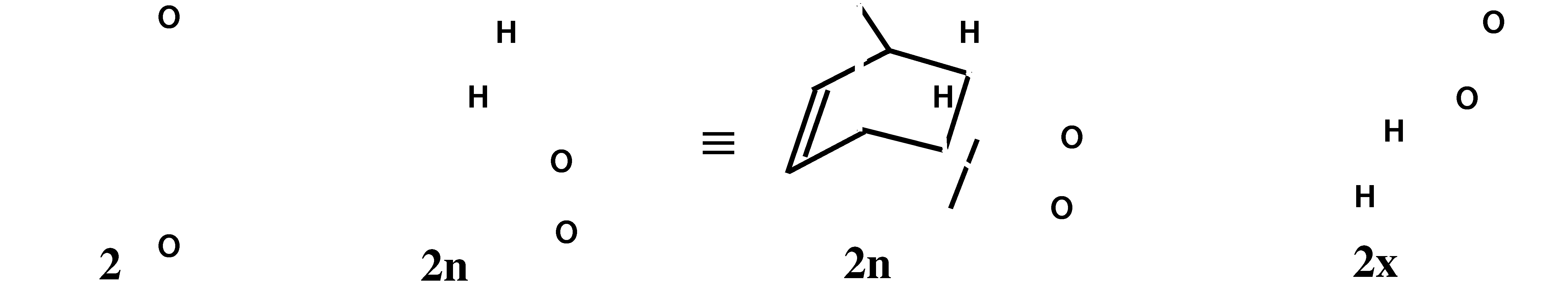
"Estudo da fotoisomerização endo® exo
de 5,8-metano-4a,5,8,8a-tetra-hidro-1,4-naftoquinonas"
Eduardo Tedeschi (IC)a, Ivan P. de Arruda Campos (PQ)b e
Daisy de Brito Rezende (PQ)a
a Depto. de Química Fundamental, Instituto de Química, USP,São Paulo, SP;
E-mail: dbrezend@quim.iq.usp.br
b Instituto de Ciências Exatas e Tecnologia, UNIP, Alphaville, Stana de Parnaíba, SP; E-mail: ipdacamp@quim.iq.usp.br
Palavras-chave: fotoisomerização, naftoquinonas, endo
Em 1906, ao reagir benzoquinona com ciclo-pentadieno, Albrecht1 obteve a primeira enodiona conhecida (2), cuja estrutura só veio a ser elucidada em 1928, por Diels e Alder.2 Em 1937, Alder e Stein3 perceberam que seria possível, no caso de 2, a existência de dois isômeros: endo (2n) e exo (2x). Finalmente, em 1964, Cookson et alii4, ao fotociclizarem 2 obtendo a pentaciclo-undecanodiona 3 (PCUD), demonstraram ser a enodiona 2 o isômero 2n (vide Esquema abaixo).
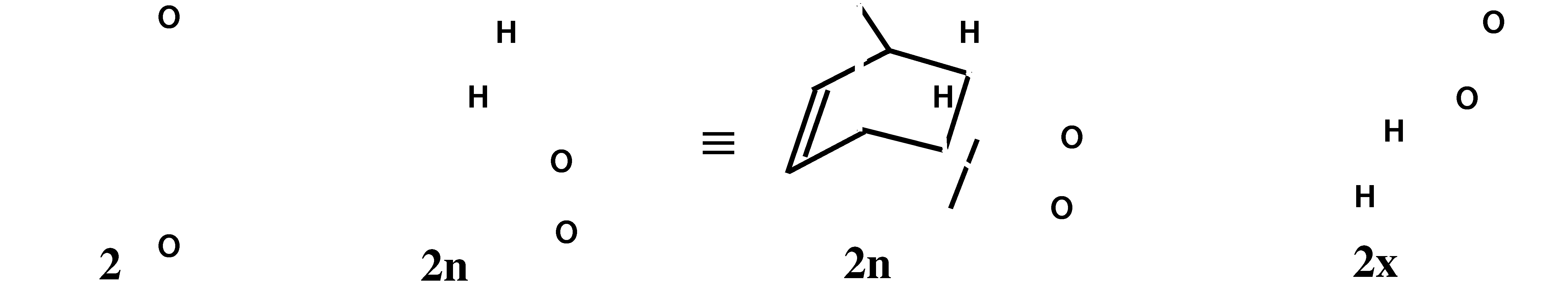
Quanto ao isômero exo (2x), este foi obtido apenas em 1990, quando Yates e Switlak5 reagiram o aduto 2:1 endo-cis-anti-cis-endo com benzoquinona, em xileno a refluxo. Esses autores também confirmaram a esperada fotoestabilidade do composto 2x. Pandey et alii6 publicaram, no mesmo mês e ano, a isomerização fotoquímica (via PET) de 2n a 2x, por irradiação em etanol/trietil-amina, com rendimento significativamente maior do que aquele relatado por Yates e Switlak.5
Além da irradiação a 313/366 nm, região de energia próxima à utilizada por Pandey e colaboradores, foram realizados experimentos em outras condições com o objetivo de investigar o comportamento fotoquímico do sistema, irradiando-se-o com diferentes comprimentos de onda. Dessa forma, irradiamos o sistema com energia mais baixa (405-430 nm) e energia mais alta (254 nm) do que a proposta na literatura.
Comparando entre si os espectros de RMN de 1H obtidos nas diversas irradiações, verificamos, através da alteração dos sinais no espectro de RMN de 1H, que o aduto 2n é totalmente convertido a fotoprodutos. O aparecimento de um singlete a 3,55 ppm sugere a formação de um novo produto X responsável por este sinal, cuja dupla enodiônica teria sido, de alguma forma, reduzida, enquanto se man-
tinha intacta a porção norbornênica do esqueleto. Os demais sinais atribuídos a este produto sustentam a hipótese de que a fração norbornênica tenha sido conservada intacta: em particular, o multiplete a 3,42 ppm seria indicativo da permanência dos prótons exo, característicos de um composto de configuração endo, na junção dos anéis dicetônico e norbornênico, semelhante à do aduto endo 2n. Este conjunto de dados espectroscópicos nos permite sugerir, para X, a estrutura preliminar que se segue, embora ainda sejam necessários dados adicionais que a confirmem.
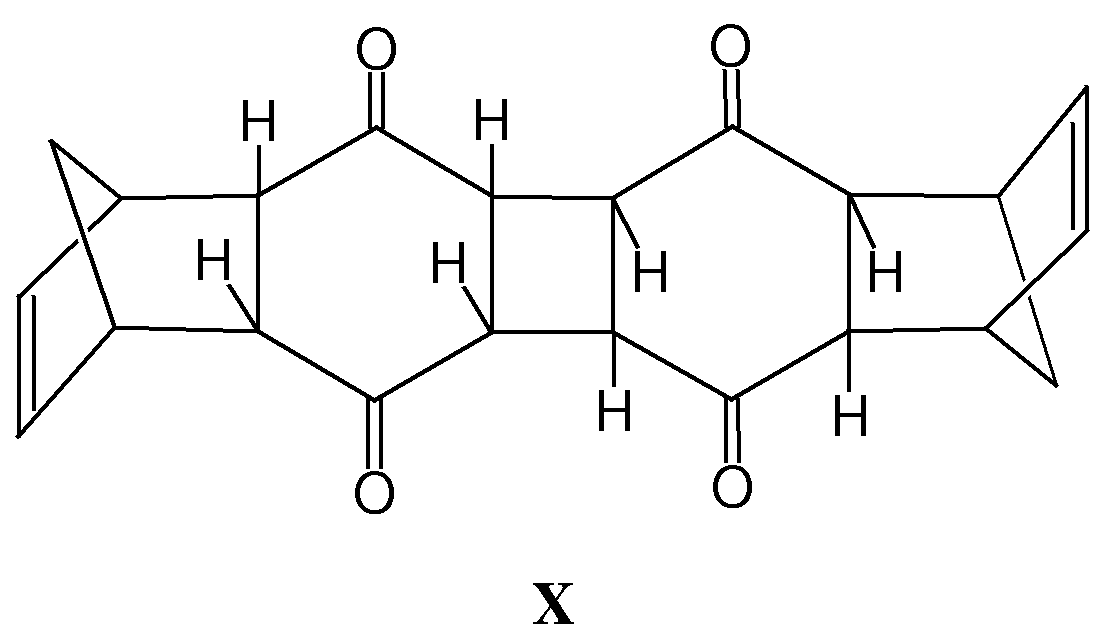
É importante ressaltar que este resultado contraria frontamente o relatado na literatura, onde se afirma que há fotoisomerização de praticamente 100% do precursor endo irradiado, não se observando formação significativa de sub-produtos.
W. Albrecht, Justus Liebigs Ann. Chem., 348, 31 (1906).
O. Diels e K. Alder, Justus Liebigs Ann. Chem., 460, 98 (1928).
K. Alder e G. Stein, Angew. Chem., 50, 510 (1937).
R. C. Cookson, R. R. Hill e J. Hudec, J. Chem. Soc., 1964, 3043.
P. Yates e K. Switlak, Can. J. Chem, 68, 1894 (1990).
(a) B. Pandey, P. V. Dalvi, A. A. Athawale, B. G. Pant e P. P. Kewale, J. Chem. Soc., Chem. Commun, 1990, 1505;
(b) B. Pandey, A. A. Athawale, R. S. Reddy, P. V. Dalvi e P. Kumar, Chem. Lett, 1991, 1173;
(c) B. Pandey e P. V. Dalvi, Angew. Chem. Int. Ed. Engl., 32, 1612 (1993).
(FAPESP, UNIP, CNPq)