INVESTIGAÇÃO
TEÓRICA E EXPERIMENTAL DA FORMAÇÃO DE ALDIMINAS
NAS FORMAS E- E Z- A PARTIR DE METILAMINA E ACETALDEÍDO
Josefredo
R. Pliego Jr. (PQ)1@,
Antônio F. C. Alcântara (PQ)2, Dorila P.
Veloso (PQ)1 e Wagner B. de Almeida (PQ)1
1
– Departamento de Química – ICEx – Universidade
Federal de Minas Gerais
2
– Departamento de Química – ICE – Universidade
do Amazonas
Palavras-chave:
mecanismo de reação, cálculos ab initio,
adição a carbonila
Os
compostos imínicos tem um grande interesse em química,
e fazem parte das rotas sintéticas de vários compostos
biologicamente ativos, como espécies com atividades
anti-viral, anti-microbiana, anti-hipertensiva e anti-tumoral. Um dos
caminhos mais usuais de geração de iminas é
através da adição de aminas a aldeídos e
cetonas, formando aldiminas e cetiminas, respectivamente. Muitos
estudos experimentais do mecanismo destas reações em
fase aquosa foram realizados, mas poucos trabalhos investigaram o
mecanismo destas reações em solventes não
aquosos1. Com relação aos estudos teóricos,
muito pouco esforço foi feito no sentido de se compreender
detalhadamente o mecanismo destas reações, tanto em
fase aquosa como em outros solventes1.
No presente trabalho, a adição de metilamina a
acetaldeído em pentano foi investigada em níveis
teórico e experimental. As estruturas de equilíbrio e
os estados de transição foram obtidas for otimização
de geometria em nível HF/6-31G*, e cálculos de energia
no ponto foram feitos em nível MP2 usando as bases 6-31G*,
6-31+G* e 6-311+G(2d,p). Na parte experimental, a reação
foi realizada a 230 K usando pentano como solvente. Após 1
hora de reação, uma alíquota da mistura de
reação foi retirada e analisada por RMN. Através
dos sinais em ( 9.75, ( 7.31 e ( 7.19, pôde-se identificar e
quantificar o reagente acetaldeído e os produtos: as aldiminas
nas formas isoméricas E- e Z-.
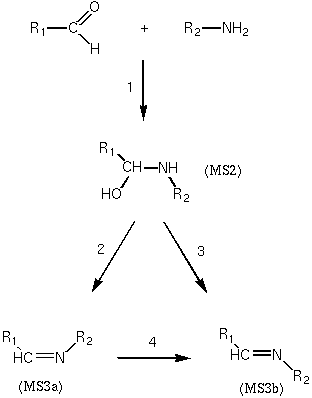
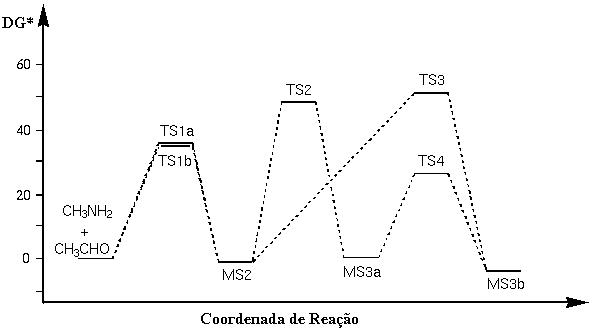
As figuras
apresentadas ilustram os resultados do presente estudo. A primeira
etapa da reação leva ao intermediário
aminoálcool (MS2). Diferentemente da forma como se acredita
que esta etapa da reação ocorra em fase aquosa, ou
seja, através de um intermediário zwiteriônico, a
formação do aminoálcool se dá de maneira
concertada quando uma molécula de acetaldeído interage
com uma molécula de metilamina. As etapas seguintes, 2 e 3,
correspondem à eliminação de água para
formar as aldiminas nas formas Z- (MS3a) e E- (MS3b),
respectivamente. A etapa 4 é uma isomerização de
Z- para E- através de uma inversão no nitrogênio
sp2. Os cálculos indicam que a etapa 2 tem uma energia livre
de ativação mais baixa, enquanto que o isômero E-
é o mais estável em termos termodinâmicos. Deste
modo, o isômero Z- seria formado sob controle cinético.
Qualitativamente, isto é observado nas medidas experimentais,
ou seja, no tempo da medida, feita em baixa temperatura, o isômero
Z- é o produto predominante.
Nossos resultados
mostram que a adição de metilamina a acetaldeído
leva aos isômeros E- e Z-, mas as alturas das barreiras de
ativação obtidas nos cálculos teóricos
indicam que a primeira etapa não é bimolecular, nem as
etapas seguintes, ou seja, eliminação de água,
são unimoleculares. Algum mecanismo catalítico está
atuando. Além disto, o intermediário zwiteriônico
não está envolvido nesta reação quando
ela é conduzida em solventes apróticos a apolares.
Referências
1. Pliego Jr., J.
R.; Alcântara, A. F. C.; Veloso, D. P.; de Almeida, W. B. J.
Braz. Chem. Soc. 1999, 10, 381.
( - Endereço
atual: Instituto de Química – Universidade de São
Paulo
CNPq, CENAPAD-MG/CO

