SÍNTESE E CARACTERIZAçÃO DE NOVOS COMPLEXOS DE FERRO(II) COM BASES DE SCHIFF N-HETEROCÍCLICAS
Vagner Roberto de Souza (PG) e Henrique Eisi Toma (PQ)
Departamento de Química Fundamental - Instituto de Química - USP
C.P. 26077, CEP 05599-970, São Paulo , Brasil
palavras-chave: ferro, iminas, N-heterocíclicos
Os ligantes imínicos N-heterocíclicos têm suscitado a atenção de vários grupos de pesquisadores e do nosso, em particular, por estarem na fronteira entre as bases de Lewis duras e moles1 e devido, também, à estabilidade dos seus compostos metálicos que apresentam ampla aplicação sintética1-4, destacando-se nas áreas de síntese orgânica, catálise, fotoquímica e modelos enzimáticos.
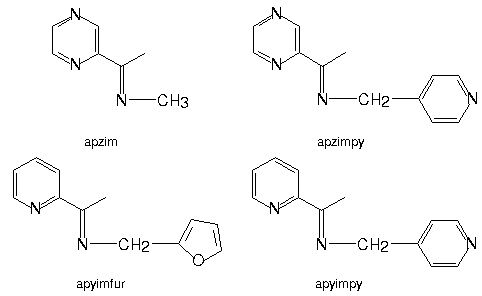
As bases de Schiff utilizadas neste estudo foram obtidas por reações de condensação de aminas com compostos N-heterocíclicos funcionalizados com cetona e estão ilustradas na figura 1. A reação destes ligantes bidentados com o complexo [Fe(CH3CN)3(OH2)3](CF3SO3)2, em acetonitrila, levou à formação de compostos violeta de fórmula geral [Fe(L)3](CF3SO3)2 ( L = iminas bidentadas ), os quais são precursores interessantes para o desenvolvimento de novas supermoléculas.

Figura 1: Fórmulas estruturais das bases de Schiff N-heterocíclicas utilizadas neste estudo.
Os resultados de análise elementar ( C, H, N ) e RMN de 1H são compatíveis com as fórmulas propostas.
Nos espectros de absorção na região do UV/Visível, verificou-se uma banda larga e intensa com máximo de absorção entre l = 550 e 570 nm e um ombro em l = 510 nm atribuídas às transições de transferência de carga do nível t2g6 do metal para o nível p* do ligante N-heterocíclico ( MLCT )5. Tal atribuíção foi suportada pela análise dos espectros de absorção obtidos concomitantemente à oxidação do metal, nos quais evidenciou-se o desaparecimento destas bandas após este processo.
Os valores de absortividade molar (e) e comprimento de onda (l) estão reunidos na tabela 1.
Tabela 1: Dados obtidos dos espectros de absorção na região do UV/Visível e
dos voltamogramas cíclicos dos compostos [Fe(L)3](CF3SO3)2.
|
Composto |
MLCT |
FeII - FeIII |
L0 - L-1 |
L-1 - L-2 |
|
|
l e ( 10-3 ) |
E½ |
E½ |
E½ |
|
[Fe(apzim)3]2+ |
510 9,20 554 12,7 |
+0,98 |
-1,23 |
-1,50 |
|
[Fe(apzimy)3]2+ |
510 3,20 564 4,50 |
+0,90* |
-1,21* |
-1,43* |
|
[Fe(apyimpy)3]2+ |
518 6,90 568 9,20 |
+0,85* |
-1,49 |
- |
|
[Fe(apyimfur)3]2+ |
520 8,50 564 10,7 |
+0,71 |
-1,55 |
-1,86 |
l = comprimento de onda ( nm ); e = absortividade molar ( cm-1 mol-1 L );
E½ = potencial de meia onda ( V ) versus Ag/Ag+ ; * = potencial de oxidação ( Epa )
A coordenação das diferentes bases de Schiff alterou significativamente a densidade eletrônica do centro metálico, conforme evidenciado na investigação eletroquímica.
Com base nos valores de potencial obtidos para o par redox FeII - FeIII, tabela 1, os novos compostos apresentam a seguinte ordem crescente de estabilidade do estado de oxidação II:
[Fe(apyimfur)3]2+ < [Fe(apyimpy)3]2+ < [Fe(apzimy)3]2+ < [Fe(apzim)3]2+
A reatividade destes complexos de ferro(II) com outros centros metálicos como por exemplo, [Fe(CN)5NH3]-3 ou [Ru(bpy)2Cl2], visando à obtenção de supermoléculas também está sendo investigada.
Referências Bibliográficas
1 - Cetinkaya, B.; et alli; J. Mol. Catal. A.: Chem., 142(2), 101, 1999.
2 - Toyota, E.; et alli; Chem. Pharm. Bull., 47(1), 116, 1999.
3 - Wang, R-M.; et alli; J. Mol. Catal. A: Chem., 147(1-2), 173, 1999.
4 - Collinson, S. R.; et alli; Coord. Chem. Rev., 148, 19, 1996.
5 - Toma, H. E.; et alli, J. Braz. Chem. Soc., 7, 391, 1996.